| на русском | in english | ||||||

|

|

|

|

|

|  |
Теоретические основы выбора дозировки препаратов
Традиционный подход выбора дозировки препарата
Докомпьютерные технологии предполагают использование фармакологических моделей препаратов в виде рекомендуемых доз и частот их введения.
Доза соответствует желательному терапевтическому интервалу при регулярном введении препарата.
Величина дозы определяется “средним” значением, зависящим от изменения концентрации препарата внутри терапевтического интервала (Jambhekar S.S., Breen P.J., 2009).
 На рисунке справа
(CRITICAL.RU) приведен пример изменения концентрации фентанила в плазме крови
после введения болюса 5 мкг/кг и повторного болюса 100 мкг через 20 мин. Согласно данным литературы (Miller R.D., 2009) нижний порог анальгетической
концентрации фентанила является 2 нг/мл. Приведенная иллюстрация демонстрирует, что при традиционном введении фентанила с 10-ой минуты и до
следующего болюса концентрация фентанила соответствует неадекватной анальгезии во время хирургической операции.
На рисунке справа
(CRITICAL.RU) приведен пример изменения концентрации фентанила в плазме крови
после введения болюса 5 мкг/кг и повторного болюса 100 мкг через 20 мин. Согласно данным литературы (Miller R.D., 2009) нижний порог анальгетической
концентрации фентанила является 2 нг/мл. Приведенная иллюстрация демонстрирует, что при традиционном введении фентанила с 10-ой минуты и до
следующего болюса концентрация фентанила соответствует неадекватной анальгезии во время хирургической операции.
Фактически подобный подход позволяет подобрать индукционные дозы, но не дает количественных и временных ориентиров для обоснования поддержания анестезии. Упрощенная и фактически неточная фармакокинетика препарата основанная на упомянутой выше “средней” концентрации препаратов для наркоза, приводит к тому, что возможный расчет суммарной дозы вводимого препарата за единицу времени (час, минута) становится неинформативным. А введение поддерживающих доз с ориентацией на клинические признаки (изменение АД, ЧСС и т.п.) без учета текущей концентрации препарата становится недостаточно обоснованным. Кроме того, приблизительность традиционного подхода не предоставляет возможности для численного анализа как текущей концентрации препарата в плазме крови, так и ее сопоставления с действием препарата на пациента.
Расчетная концентрация - лучший выбор
Существование фармакологических моделей препаратов, используемых при проведении общей анестезии, позволяет получать расчетные концентрации
этих препаратов для любого интересующего врача момента времени.
Подобный подход позволяет анализировать и общую введенную дозу, и тактику введения составляющих ее частей,
а также величину поддерживаемой концентрации препарата.
С учетом того, что параметры фармакологических моделей рассчитываются для определенных групп добровольцев с учетом их антропометрических,
половых, возрастных и других параметров, широкий выбор моделей позволяет доктору анализировать изменение концентрация любого назначенного им препарата в
зависимости от выбранной группы.
Фармакологические камерные модели
Для описания фармакокинетики лекарственных средств используются фармакологические камерные модели.
Это математические модели, представляющие собой упрощенные схемы элиминации и перераспределения препарата в камерах.
Каждая модель определяет количество камер и их объемы, скорость метаболизма и элиминации препарата,
а также скорость перераспределения между камерами.
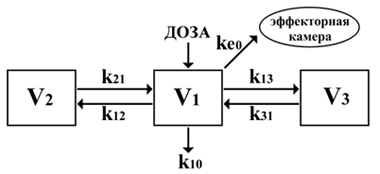 Общепринято центральной (V1) называть камеру, в которую вводится препарат;
вторую и третью (если она представлена в модели) – периферическими камерами.
Камеры моделей являются теоретическими и не имеют реальных анатомо-физиологических связей.
Скорость метаболизма и распределения препарата описывается константами скорости (k) (Absalom A.R., 2007).
Общепринято центральной (V1) называть камеру, в которую вводится препарат;
вторую и третью (если она представлена в модели) – периферическими камерами.
Камеры моделей являются теоретическими и не имеют реальных анатомо-физиологических связей.
Скорость метаболизма и распределения препарата описывается константами скорости (k) (Absalom A.R., 2007).
Концентрация в эффекторной камере
После начала введения препарата наблюдается короткий латентный период между подъемом его плазменной концентрацией и появлением клинического эффекта, а после прекращения инфузии падение концентрации предшествует снижению эффекта введенного препарата.
Это объясняется тем, что клинический эффект определяется концентрацией лекарства не в плазме крови, а в ткани-мишени.
Для лучшей интерпретации фармакокинетики и фармакодинамики анестетиков, к фармакологической модели добавлена «эффекторная камера» (Hull C.J., 1978),
отражающая концентрацию препарата в месте его действия (Ce).
Скорость движения препарата в эту камеру и выведения его описывается только одной константой, которая обычно обозначается как ke0.
Так как концентрация препарата в органе-мишени не может быть напрямую измерена,
но расчет Ce осуществляется на основе константы ke0, которая отражает время до достижения пиковой концентрации препарата в эффекторной камере.
Эта константа устанавливается путем измерения клинического эффекта, например, при помощи ЭЭГ.
Точность фармакологических моделей
Для проверки точности работы фармакологической модели проводятся исследования,
в которых сопоставляют ретроспективно измеренные концентрации препарата в пробах крови и расчетные концентрации
в соответствующих временных точках.
Наиболее часто используемые критерии для оценки точности фармакокинетических моделей включают MDPE
(median performance error – средняя рабочая ошибка),
MDAPE (median absolute performance error – средняя абсолютная рабочая ошибка) (Varvel J.R. et al., 1992).
Для фармакологических моделей удовлетворительными являются значения MDPE до 10-20% и MDAPE до 20-40% (Schuttler J. et al., 1988; Glass P.J.A. et al., 1990), что сопоставимо с точностью
измерения концентрации ингаляционных анестетиков в конце выдоха. Так, концентрация изофлюрана в конце выдоха отличается от
измеренной в артериальной крови на 20% (Frei F.J. et al., 1991; Dwyer R.C. et al., 1991).
Наиболее часто используемые фармакокинетические модели для препаратов внутривенной анестезии соответствуют указанным нормам по точности.
Однако отклонение расчетной концентрации от реальной допускается вследствие массивной
интрооперационной кровопотери, большого объема внутривенной инфузии. Для решения этой проблемы требуется расширение мониторируемых показателей для
обеспечения адекватной обратной связи.
Возможность анализировать концентрации всех используемых препаратов во время операции –
это еще одно направление анестезиологического мониторинга, которое позволяет сопоставлять текущие концентрации препаратов
с действиями хирургов в данный момент времени, с характеристиками кровообращения, ЭЭГ, ЭКГ и любыми другими активно изменяющимися
показателями. Существуют рекомендации по выбору и поддержке концентрации препаратов для анестезии во время проведения различных этапов
операций, которые являются основой для подбора тактики введения препаратов. Перейти в раздел "Рекомендации" 
1.Absalom A.R., Struys R.F. An Overview of TCI and TIVA. Belgium: Gent, Academia Press, 2007. – 108 p.
2.Dwyer R.C., Fee J.P., Howard P.J., Clarke R.S. Arterial washin of halothane and isoflurane in young and eldery adult patients. Br. J. Anaesth. – 1991. – Vol. 66. – P. 572–579.
3.Frei F.J., Zbinden A.M., Thomson D.A., Rieder H.U. Is the end–tidal partial pressure of isoflurane a good predictor of its arterial partial pressure? Br. J. Anaesth. – 1991. – Vol. 66. – P. 331–339.
4.Glass P.S., Jacobs J.R., Smith L.R. et al. Pharmacokinetic model–driven infusion of fentanyl: Assessment of accuracy. Anesthesiology. 1990. – Vol. 73. – P. 1082–1090.
5.Hull C.J., Beem H.B.H., McLeon K. et al. A pharmacodynamic model for pancuronium. Br. J. Anaesth. – 1978. – Vol. 50. – P. 1113–1123.
6.Jambhekar S.S., Breen P.J. Basic Pharmacokinetics, Pharmaceutical Press, 2009, p. 425
7.Miller R.D. Miller's anesthesia. 7th edition. 2009. Раздел III: Anesthetic Pharmacology.
8.Schuttler J., Kloos S., Schwilden H., Stoeckel H. Total intravenous anaesthesia with propofol and alfentanil be computer–assisted infusion. Anaesthesia. – 1988. – Vol. 43. – P. 2–7.
9.Varvel J.R., Donoho D.L., Shafer S.L. Measuring the predictive performance of computer–controlled infusion pumps. J. Pharmacokinet. Biopharm. – 1992. – Vol. 20. – P. 63–94.
| ANAESTHSOFTWARE.COM
| |